このページでは、電気化学(電池)と電気加工について、初心者の方でも解りやすいように、基礎から解説しています。また、電験三種の機械科目の試験で実際に出題された、電気化学(電池)と電気加工の過去問題の解き方も解説しています。
- 電池のしくみ
- 電池の種類と特徴
- 電気加工
- 電験三種-機械(電気化学)過去問
- 1999年(平成11年)問8
- 1999年(平成11年)問8 過去問解説
- 2002年(平成14年)問8
- 2002年(平成14年)問8 過去問解説
- 2003年(平成15年)問12
- 2003年(平成15年)問12 過去問解説
- 2005年(平成17年)問12
- 2005年(平成17年)問12 過去問解説
- 2006年(平成18年)問12
- 2006年(平成18年)問12 過去問解説
- 2008年(平成20年)問13
- 2008年(平成20年)問13 過去問解説
- 2009年(平成21年)問12
- 2009年(平成21年)問12 過去問解説
- 2013年(平成25年)問12
- 2013年(平成25年)問12 過去問解説
- 2014年(平成26年)問12
- 2014年(平成26年)問12 過去問解説
- 2016年(平成28年)問12
- 2016年(平成28年)問12 過去問解説
電池のしくみ
電子が移動することが電流です。電流が流れる方向は、電子の移動方向と逆向きになります。電池では、化学反応(酸化還元反応)を起こすことで、電子の移動を起こして電流を流します。基本的な電池である「ボルタ電池」を例に酸化還元反応を説明します。
図のように亜鉛板(Zn)と銅板(Cu)を希硫酸(H2SO4)にひたし両者を導線でつなぎます。
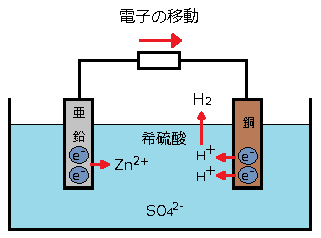
亜鉛と銅では、亜鉛の方がイオン化傾向が高いため、亜鉛板が希硫酸に溶け出します。亜鉛が希硫酸に溶け出すと、亜鉛(Zn)が陽イオン(Zn2+)になり、電子(2e–)が発生します。
Zn(亜鉛) ⇒ Zn2+(亜鉛イオン) + 2e–(電子)
発生した電子は、導線を通して、銅板Cuへと流れます。そこで電子(2e–)は、希硫酸中に存在している水素イオン(H+)と結合し、気体の水素(H2)を発生させます。
2H+(水素イオン) + 2e–(電子) ⇒ H2(水素)
このような化学反応を酸化還元反応といいます。このように、「酸化還元反応」が起こることで、導線には電流(=電子の流れ)が発生します。
| 酸化 | 電子を放出(亜鉛 |
| 還元 | 電子を受け取る(水素イオン |
電池の構成要素
化学変化を起こしてエネルギーを放出し、電池反応を起こして外部に電気エネルギーとして取り出すことができる物質を活物質といいます。
活物質は、負極と正極に使われています。負極に使われるものを負極活物質、正極に使われるものを正極活物質といいます。活物質には、電極に保持させたものと連続的に電極に補給するものがあります。
負極活物質は、還元剤(ボルタ電池では亜鉛)として使われ、放電により酸化反応を起こします。また、正極活物質は、酸化剤(ボルタ電池では銅)として使われ、放電により還元反応を起こします。電池は、この酸化還元反応の際の自由エネルギーを、電気エネルギーとして利用しています。
電池の種類と特徴
化学反応を利用した電池は大まかに、一次電池,二次電池,燃料電池の3種類に分類できます。
- 一次電池
1度放電させると使えなくなってしまう電池です。乾電池と湿電池があります。乾電池は電解質がのり状または含浸状で、湿電池は電解質が液状のものをいいます。 - 二次電池
起電力が低下した場合、外部から放電と逆向きに電流を流して、充電すれば起電力が回復して、再び使用できる電池です。 - 燃料電池
燃料と酸素を外部から供給する電池です。水を電気分解すると水素と酸素にわかれるという、「水の電気分解」の原理を応用しています。
一次電池の種類と特徴
| 電池名 | 正極 | 電解液 | 負極 | 公称 電圧 | 特徴、用途など |
|---|---|---|---|---|---|
| マンガン乾電池 | MnO2 | NH4Cl +ZnCl2 | Zn | 1.5V | 間欠使用に適 軽負荷に適 |
| マンガン乾電池 (塩化亜鉛形) | MnO2 | ZnCl2 | Zn | 1.5V | 大電流放電特性が良 低温特性が良 |
| アルカリ乾電池 | MnO2 | KOH | Zn | 1.5V | 電池容量が大 内部抵抗が小 低温特性が良 |
| ニッケル系乾電池 | NiOOH +MnO2 | KOH | Zn | 1.5V | 電池容量が大 大電流特性が良 |
| 酸化銀電池 | Ag2O | KOH NaOH | Zn | 1.5V | 大電流特性が良 低温特性が良 |
| 空気乾電池 | O2 | KOH | Zn | 1.3V | 軽負荷専用 低温特性が良 |
| リチウム電池 | MnO2 (CF)n | LiClO4 | Li | 3.0V | 電池電圧が高 エネルギー密度が大 低温特性が良 |
二次電池の種類と特徴
鉛蓄電池(公称電圧2V)
正極に二酸化鉛(PbO2)、負極に鉛(Pb)が使われ、電解質は硫酸(H2SO4)で構成されています。電解液は放電と共に硫酸が消費され、水ができますので、比重は軽くなります。

過放電や放電したまま放置すると、極板上に白色の硫酸鉛が発生し、充電できなくなります。この現象をサルフェーションといいます。
電解液の温度が上昇すると、電池の端子電圧が上昇し、取り出せる電気量が増加しますが、自己放電も増加します。
アルカリ畜電池
電解質に水酸化カリウム(KOH)などのアルカリ性のものを用いた蓄電池です。活物質の違いにより、ニッケル・カドミウム(ニッカド)電池,ニッケル・水素電池,ニッケル・鉄電池などがあります。
鉛蓄電池に対して高率放電が可能で、放電終止電圧以上に放電しても容量の低下がありません。また、サイクル寿命(充放電回数)が長いなどの特長があります。
アルカリ畜電池は、つぎ足し充電を行った時、つぎ足した充電分しか使用できません。この現象をメモリ現象といいます。メモリ現象の回復は、リフレッシュ(電池をすべて放電してから再び充電することを繰り返す)を行います。メモリ現象の防止は、充電する前は、放電終止電圧まで放電してから充電を行います。
ニッケル・カドミウム電池(公称電圧1.2V)
正極にニッケル酸化物(NiOOH)、負極にカドミウム(Cd)を用いた蓄電池です。

ニッケル水素電池(公称電圧1.2V)
正極にニッケル酸化物(NiOOH)、負極に水素吸蔵合金を用いた蓄電池です。ニッケル・カドミウム電池の約2倍の容量があります。

ニッケル・鉄電池(公称電圧1.2V)
正極にニッケル酸化物(NiOOH)、負極に鉄(Fe)を用いた蓄電池です。

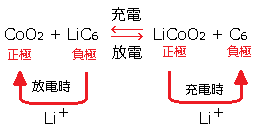
リチウムイオン電池(公称電圧3.6V)
正極にコバルト酸リチウム(LiCoO2)、負極に特殊カーボン(C)が使われ、電解質は有機電解質で構成されています。他の二次電池と比べて、公称電圧が高く、エネルギー密度も大きいのが特徴です。
ナトリウム・硫黄電池(NAS電池)
正極に硫黄(S)、負極にナトリウム(Na)、電解質はファインセラミックスなどの有機電解質で構成されています。使用されている硫黄とナトリウムが危険物指定されている点や、作業時には作業温度を300度に維持する必要があるため、取り扱い上での安全性が懸念されているというデメリットがあります。メガワット級の電力貯蔵設備に使われています。
電池の自己放電
電池が持っている電気エネルギーを電池内部で消耗する現象を自己放電といいます。自己放電量は温度の上昇と共に増加します。自己放電の主な原因は、次のとおりです。
- 活物質中の不純物による局部電池作用
- 電解液中の不純物イオンによるもの
- 酸化されやすい有機物などが、正極活性物を還元する
電気加工
工業プロセスで用いられている電気加工について紹介します。
イオン交換膜法
イオン交換膜と電気分解を用いて、塩化ナトリウム水溶液から水酸化ナトリウムを合成する電解法です。イオン交換膜は、イオン交換樹脂を膜状にしたもので、異符号のイオンの通過を阻止し、同符号のイオンのみを通過させる。イオン交換膜法では副産物として塩素と水素が得られます。
2NaCl+2H2O⟶Cl2+H2+2NaOH
国内では、食塩電解の工業プロセスで用いられています。
金属の電解採取と電解精製
採取する金属を含む鉱石を電解液中に溶解し、電解により純金属を陰極に析出させる方法を電解採取といいます。銅、亜鉛、カドミウム、コバルト、クロム、マンガンなどについて行われています。
銅、アルミニウム、鉄などの金属は一般に鉱石を加工して作られますが、純度が99%以上を要求されるとさらに精製しなければななりません。そこで、電解法により精製するものを電解精製といいます。銅、銀、金、ニッケルが工業化されています。いずれも粗金属を陽極とし、その中の主成分を電解により電解液中に溶解させ、陰極に純金属を析出させます。
電気めっき
加工物をめっき液(金属イオンを含む水溶液)中で陰極として電解し、その表面に金属膜を析出させる方法を電気めっきといいます。電気めっきは次のようなところで、使われています。
- 金、白金などの貴金属の装飾用
- ニッケル・クロムめっきなどの装飾兼防食用
- 亜鉛やすずなどの防食用めっき
- ニッケルめっき、クロムめっきなどの工業用
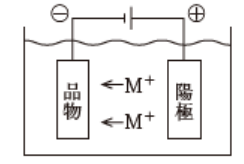
電気めっきの原理
品物をマイナス極にして通電することにより、めっき液中の金属イオン(M+)が引き寄せられて金属膜となります。
電着塗装
導電性のよい水溶性合成樹脂塗料またはエマルジョン塗料を含む溶液を用いて、被塗装物を一方の電極として電気を通じることにより、電気泳動によって被塗装物表面に塗料が析出します。この塗装を電着塗装といいます。
電験三種-機械(電気化学)過去問
1999年(平成11年)問8
鉛蓄電池( A )、ニッケル・カドミウム蓄電池( B )、リチウムイオン電池( C )の三種類の二次電池の電解質の組み合わせとして、正しいのは次のうちどれか。
| (A) | (B) | (C) | |
|---|---|---|---|
| (1) | 有機電解質 | 水酸化カリウム | 希硫酸 |
| (2) | 希硫酸 | 有機電解質 | 水酸化カリウム |
| (3) | 水酸化カリウム | 希硫酸 | 有機電解質 |
| (4) | 希硫酸 | 水酸化カリウム | 有機電解質 |
| (5) | 有機電解質 | 希硫酸 | 水酸化カリウム |
1999年(平成11年)問8 過去問解説
鉛蓄電池の電解質には希硫酸、NiCd電池の電解質には水酸化カリウム、リチウムイオン電池の電解質には有機電解質が用いられています。
答え (4)
2002年(平成14年)問8
据置形蓄電池に関する記述として、誤っているのは次のうちどれか。
- 周囲温度が上ると、電池の端子電圧は上昇する。
- 電解液の液面が低下した場合には、純水を補給する。
- 単セル(単電池)の公称電圧は 2.0[V]である。
- 周囲温度が低下すると、電池から取り出せる電気量は増加する。
- 放電に伴い、電解液の比重は低下する。
2002年(平成14年)問8 過去問解説
この問いの据置形蓄電池とは鉛蓄電池のことだと思われます。鉛蓄電池の電解質の抵抗特性は負なので、気温が下がると抵抗が大きくなり、出力が減少します。また、化学反応の能力も低下するため、出力が減少します。したがって、(4)の記述が誤りです。
答え (4)
2003年(平成15年)問12
3種類の二次電池をそれぞれの容量[A・h]に応じた一定の電流で放電したとき、放電特性は図のA、B及びCのようになった。A,B及びCに相当する電池の種類として、正しいものを組合わせたのは次のうちどれか。
ただし、電池電圧は単セル(単電池)の電圧である。
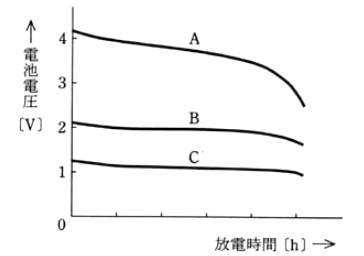
| A | B | C | |
|---|---|---|---|
| (1) | リチウムイオン 二次電池 | 鉛蓄電池 | ニッケル・水素蓄電池 |
| (2) | リチウムイオン 二次電池 | ニッケル・水素蓄電池 | 鉛蓄電池 |
| (3) | 鉛蓄電池 | リチウムイオン 二次電池 | ニッケル・水素蓄電池 |
| (4) | 鉛蓄電池 | ニッケル・水素蓄電池 | リチウムイオン 二次電池 |
| (5) | ニッケル・水素蓄電池 | 鉛蓄電池 | リチウムイオン 二次電池 |
※「ニッケル・水素蓄電池」は、「ニッケル-金属水素化物電池」と呼ぶこともある。
2003年(平成15年)問12 過去問解説
- リチウムイオン二次電池の公称電圧は 3.6[V]です。
- 鉛蓄電池の公称電圧は 2[V]です。
- ニッケル・水素蓄電池の公称電圧は 1.2[V]です。
答え (1)
2005年(平成17年)問12
水溶液中に固体の微粒子が分散している場合、微粒子は溶液中の( ア )を吸着して帯電することがある。この溶液中に電極を挿入して直流電圧を加えると、微粒子は自身の電荷と( イ )の電極に向かって移動する。
この現象を( ウ )という。この現象を利用して、陶土や粘土の精製、たんぱく質や核酸、酵素などの分離精製や分析などが行われている。
また、良い導電性の( エ )合成樹脂塗料又はエマルジョン塗料を含む溶液を用い、被塗装物を一方の電極として電気を通じると、塗料が( ウ )によって被塗装物表面に析出する。この塗装は電着塗装と呼ばれ、自動車や電気製品などの大量生産物の下地塗料に利用されている。
上記の記述中の空白箇所(ア),(イ),(ウ)及び(エ)に記入する語句として、正しいものを組み合わせたのは次のうちどれか。
| (ア) | (イ) | (ウ) | (エ) | |
|---|---|---|---|---|
| (1) | 水分 | 同符号 | 電気析出 | 油性 |
| (2) | イオン | 逆符号 | 電気泳動 | 水溶性 |
| (3) | イオン | 同符号 | 電気析出 | 水溶性 |
| (4) | イオン | 逆符号 | 電気泳動 | 揮発性 |
| (5) | 水分 | 逆符号 | 電気透析 | 油性 |
2005年(平成17年)問12 過去問解説
水溶液中に固体の微粒子が分散している場合、微粒子は溶液中の( イオン )を吸着して帯電することがある。この溶液中に電極を挿入して直流電圧を加えると、微粒子は自身の電荷と( 逆符号 )の電極に向かって移動する。
この現象を( 電気泳動 )という。この現象を利用して、陶土や粘土の精製、たんぱく質や核酸、酵素などの分離精製や分析などが行われている。
また、良い導電性の( 水溶性 )合成樹脂塗料又はエマルジョン塗料を含む溶液を用い、被塗装物を一方の電極として電気を通じると、塗料が( 電気泳動 )によって被塗装物表面に析出する。この塗装は電着塗装と呼ばれ、自動車や電気製品などの大量生産物の下地塗料に利用されている。
電気泳動とは、水溶液中に固体の微粒子が分散している場合、微粒子は溶液中のイオンを吸着して帯電することがあります。この溶液中に電極を装入して直流電圧を加えると、微粒子は自身の電荷と逆符号の電極に向かって移動する現象です。
答え (2)
2006年(平成18年)問12
ニッケル水素蓄電池※は、電解液として( ア )水溶液を用い、( イ )にオキシ水酸化ニッケル、( ウ )に水素吸蔵合金をそれぞれ活物質として用いる。
公称電圧は( エ )[V]である。
この電池は、形状,電圧特性などはニッケル・カドミウム蓄電池に類似し、さらに、ニッケル・カドミウム蓄電池に比べ、( オ )が高く、カドミウムの環境問題が回避できる点が優れているので、デジタルカメラ,MDプレーヤ,ノートパソコンなど携帯形電子機器用の電源として使用されてきたが、近年、携帯用電動工具用やハイブリッド車用の電池としても使用されるようになってきている。
(注)※の「ニッケル・水素蓄電池」は、「ニッケル・金属水素化物電池」と呼ぶこともある。
上記の記述の空白箇所(ア),(イ),(ウ),(エ)及び(オ)に当てはまる語句又は数値として、正しいものを組み合わせたのは次のうちどれか。
| (ア) | (イ) | (ウ) | (エ) | (オ) | |
|---|---|---|---|---|---|
| (1) | H2SO4 | 正極 | 負極 | 1.5 | 耐過放電性能 |
| (2) | KOH | 負極 | 正極 | 1.2 | 体積エネルギー密度 |
| (3) | KOH | 正極 | 負極 | 1.5 | 耐過放電性能 |
| (4) | KOH | 正極 | 負極 | 1.2 | 体積エネルギー密度 |
| (5) | H2SO4 | 負極 | 正極 | 1.2 | 耐過放電性能 |
2006年(平成18年)問12 過去問解説
ニッケル水素蓄電池は、電解液として( KOH )水溶液を用い、( 正極 )にオキシ水酸化ニッケル、( 負極 )に水素吸蔵合金をそれぞれ活物質として用いる。
公称電圧は( 1.2 )[V]である。
この電池は、形状,電圧特性などはニッケル・カドミウム蓄電池に類似し、さらに、ニッケル・カドミウム蓄電池に比べ、( 体積エネルギー密度 )が高く、カドミウムの環境問題が回避できる点が優れているので、デジタルカメラ,MDプレーヤ,ノートパソコンなど携帯形電子機器用の電源として使用されてきたが、近年、携帯用電動工具用やハイブリッド車用の電池としても使用されるようになってきている。
答え (4)
2008年(平成20年)問13
二次電池は、電気エネルギーを化学エネルギーに変えて電池内に蓄え(充電という)、貯蔵した化学エネルギーを必要に応じて電気エネルギーに変えて外部負荷に供給できる(放電という)電池である。この電池は充放電を反復して使用できる。
二次電池としてよく知られている鉛蓄電池の充電時における正・負両電極の化学反応(酸化・還元反応)に関する記述として、正しいのは次のうちどれか。
なお、鉛蓄電池の充放電反応全体をまとめた化学反応式は次のとおりである。
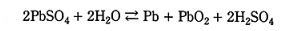
- 充電時には正極で酸化反応が起き、正極活性物質は電子を放出する。
- 充電時には負極で還元反応が起き、PbSO4 が生成する。
- 充電時には正極で還元反応が起き、正極活物質は電子を受け取る。
- 充電時には正極で還元反応が起き、PbSO4 が生成する。
- 充電時には負極で酸化反応が起き、負極活物質は電子を受け取る。
2008年(平成20年)問13 過去問解説
鉛蓄電池の充電時は、正極では酸化,負極では還元反応が起こります。正極活物質は二酸化鉛、負極活性物質は鉛、電解質は硫酸です。充電反応としては、硫酸鉛から鉛イオンが還元されて金属鉛となり、正極では同じく鉛イオンが 2 価から酸化されて(電子放出)二酸化鉛になります。したがって、(1)が正しい記述です。

答え (1)
2009年(平成21年)問12
食塩水を電気分解して、水酸化ナトリウム(NaOH、か性ソーダ)と塩素(Cl2)を得るプロセスは食塩電解と呼ばれる。食塩電解の工業プロセスとして、現在、わが国で採用されているものは、( ア )である。
この食塩電解法では、陽極側と陰極側を仕切る際に( イ )イオンだけを選択的に透過する密隔膜が用いられている。外部電源から電流を流すと、陽極側にある食塩水と陰極側にある水との間で電気分解が生じてイオンの移動が起こる。陽極側で生じた( ウ )イオンが密隔膜を通して陰極側に入り、( エ )となる。
上記の記述の空白箇所(ア),(イ),(ウ)及び(エ)に当てはまる語句として、正しいものを組み合わせたのは次のうちどれか。
| (ア) | (イ) | (ウ) | (エ) | |
|---|---|---|---|---|
| (1) | 隔膜法 | 陽 | 塩素 | Cl2 |
| (2) | イオン交換膜法 | 陽 | ナトリウム | NaOH |
| (3) | イオン交換膜法 | 陰 | 塩素 | Cl2 |
| (4) | イオン交換膜法 | 陰 | ナトリウム | NaOH |
| (5) | 隔膜法 | 陰 | 水酸 | NaOH |
2009年(平成21年)問12 過去問解説
食塩水を電気分解して、水酸化ナトリウム(NaOH、か性ソーダ)と塩素(Cl2)を得るプロセスは食塩電解と呼ばれる。食塩電解の工業プロセスとして、現在、わが国で採用されているものは、( イオン交換膜法 )である。
この食塩電解法では、陽極側と陰極側を仕切る際に( 陽 )イオンだけを選択的に透過する密隔膜が用いられている。外部電源から電流を流すと、陽極側にある食塩水と陰極側にある水との間で電気分解が生じてイオンの移動が起こる。陽極側で生じた( ナトリウム )イオンが密隔膜を通して陰極側に入り、( NaOH )となる。
答え (2)
2013年(平成25年)問12
次の文章は、電気めっきに関する記述である。
金属塩の溶液を電気分解すると( ア )に純度の高い金属が析出する。この現象を電着と呼び、めっきなどに利用されている。ニッケルめっきでは硫酸ニッケルの溶液にニッケル板(( イ ))とめっきを施す金属板(( ア ))とを入れて通電する。硫酸ニッケルの溶液は、ニッケルイオン(( ウ ))と硫酸イオン(( エ ))とに電離し、ニッケルイオンがめっきを施す金属板表面で電子を( オ )金属ニッケルとなり、金属板表面に析出する。めっきは金属製品の装飾のほか、金属材料の耐食性や耐摩耗性を高める目的で利用されている。
上記の記述中の空白箇所(ア),(イ),(ウ),(エ)及び(オ)に当てはまる組合せとして、正しいものを次の(1)~(5)のうちから一つ選べ。
| (ア) | (イ) | (ウ) | (エ) | (オ) | |
|---|---|---|---|---|---|
| (1) | 陽極 | 陰極 | 負イオン | 正イオン | 放出して |
| (2) | 陰極 | 陽極 | 正イオン | 負イオン | 受け取って |
| (3) | 陽極 | 陰極 | 正イオン | 負イオン | 受け取って |
| (4) | 陰極 | 陽極 | 負イオン | 正イオン | 受け取って |
| (5) | 陽極 | 陰極 | 正イオン | 負イオン | 放出して |
2013年(平成25年)問12 過去問解説
金属塩の溶液を電気分解すると( 陰極 )に純度の高い金属が析出する。この現象を電着と呼び、めっきなどに利用されている。ニッケルめっきでは硫酸ニッケルの溶液にニッケル板((陽極))とめっきを施す金属板((陰極))とを入れて通電する。硫酸ニッケルの溶液は、ニッケルイオン((正イオン))と硫酸イオン((負イオン))とに電離し、ニッケルイオンがめっきを施す金属板表面で電子を( 受け取って )金属ニッケルとなり、金属板表面に析出する。めっきは金属製品の装飾のほか、金属材料の耐食性や耐摩耗性を高める目的で利用されている。
答え (2)
2014年(平成26年)問12
次の文章は、燃料電池に関する記述である。
( ア )燃料電池は80~100℃程度で動作し、家庭用などに使われている。燃料には都市ガスなどが使われ、( イ )を通して水素を発生させ、水素は燃料極へと導かれる。燃料極において水素は電子を( ウ )水素イオンとなり、電解質の中へ浸透し、空気極において電子を( エ )酸素と結合し、水が生成される。放出された電子が電流として負荷に流れることで直流電源として動作する。また、発電時には( オ )反応が起きる。
上記の記述中の空白箇所(ア),(イ),(ウ),(エ)及び(オ)に当てはまる組合せとして、正しいものを次の(1)~(5)のうちから一つ選べ。
| (ア) | (イ) | (ウ) | (エ) | (オ) | |
|---|---|---|---|---|---|
| (1) | 固体高分子形 | 改質器 | 放出して | 受け取って | 発熱 |
| (2) | りん酸形 | 燃焼器 | 受け取って | 放出して | 吸熱 |
| (3) | 固体高分子形 | 改質器 | 放出して | 受け取って | 吸熱 |
| (4) | りん酸形 | 改質器 | 放出して | 受け取って | 発熱 |
| (5) | 固体高分子形 | 燃焼器 | 受け取って | 放出して | 発熱 |
2014年(平成26年)問12 過去問解説
( 固体高分子形 )燃料電池は80~100℃程度で動作し、家庭用などに使われている。燃料には都市ガスなどが使われ、( 改質器 )を通して水素を発生させ、水素は燃料極へと導かれる。燃料極において水素は電子を( 放出して )水素イオンとなり、電解質の中へ浸透し、空気極において電子を( 受け取って )酸素と結合し、水が生成される。放出された電子が電流として負荷に流れることで直流電源として動作する。また、発電時には( 発熱 )反応が起きる。
答え (1)
2016年(平成28年)問12
電池に関する記述として、誤っているものを次の(1)~(5)のうちから一つ選べ。
- 充電によって繰り返し使える電池は二次電池と呼ばれている。
- 電池の充放電時に起こる化学反応において、イオンは電解液の中を移動し、電子は外部回路を移動する。
- 電池の放電時には正極では還元反応が、負極では酸化反応が起こっている。
- 出力インピーダンスの大きな電池ほど大きな電流を出力できる。
- 電池の正極と負極の物質のイオン化傾向の差が大きいほど開放電圧が高い。
2016年(平成28年)問12 過去問解説
電池の出力インピーダンスが大きいということは、内部抵抗が大きいということです。つまり、出力電流は小さくなります。したがって、(4)の記述が誤りです。
答え (4)





